Simpele kopergekatalyseerde oxidatie van ammoniak naar nitraat en nitriet
Met behulp van een koperkatalysator in een basische oplossing kun je via een elektrochemisch proces eenvoudig ammoniak omzetten in nitraat of nitriet, laten onderzoekers zien in ChemSusChem [1]. Het industriële proces voor de productie van nitraat en nitriet is niet erg duurzaam, omdat daarbij CO2 en N2O vrijkomen. Via het nieuwe, duurzamere proces is er selectief nitraat of nitriet aan te maken door middel van elektrochemische oxidatie van ammoniak.
de traditionele methode
Nitriet en nitraat zijn belangrijke moleculen met veel biologische en industriële toepassingen, waaronder kunstmest en explosieven (nitraat) en het voorkomen van roest en synthese van farmaceutica (nitriet). Nu is het produceren van deze stoffen nog niet erg duurzaam. Op grote schaal wordt nitriet (NaNO2) geproduceerd door gasvormig N2O en NO door een oplossing van NaOH en Na2CO3 te laten borrelen in de aanwezigheid van een katalysator. Eén molecule CO2 wordt geproduceerd bij iedere twee moleculen natriumnitriet. Nitraten (salpeterzuur) worden traditioneel geproduceerd door katalytische oxidatie van ammoniak met het Ostwaldproces op hoge temperatuur, dat platina als katalysator heeft. Bij dit Ostwaldproces bestaat tussen de 0,5 en 2,5% van de totale productie uit N2O, dat een broeikasgas is dat circa 300 keer sterker is dan CO2 als het zich in de atmosfeer bevindt.
een duurzaam alternatief
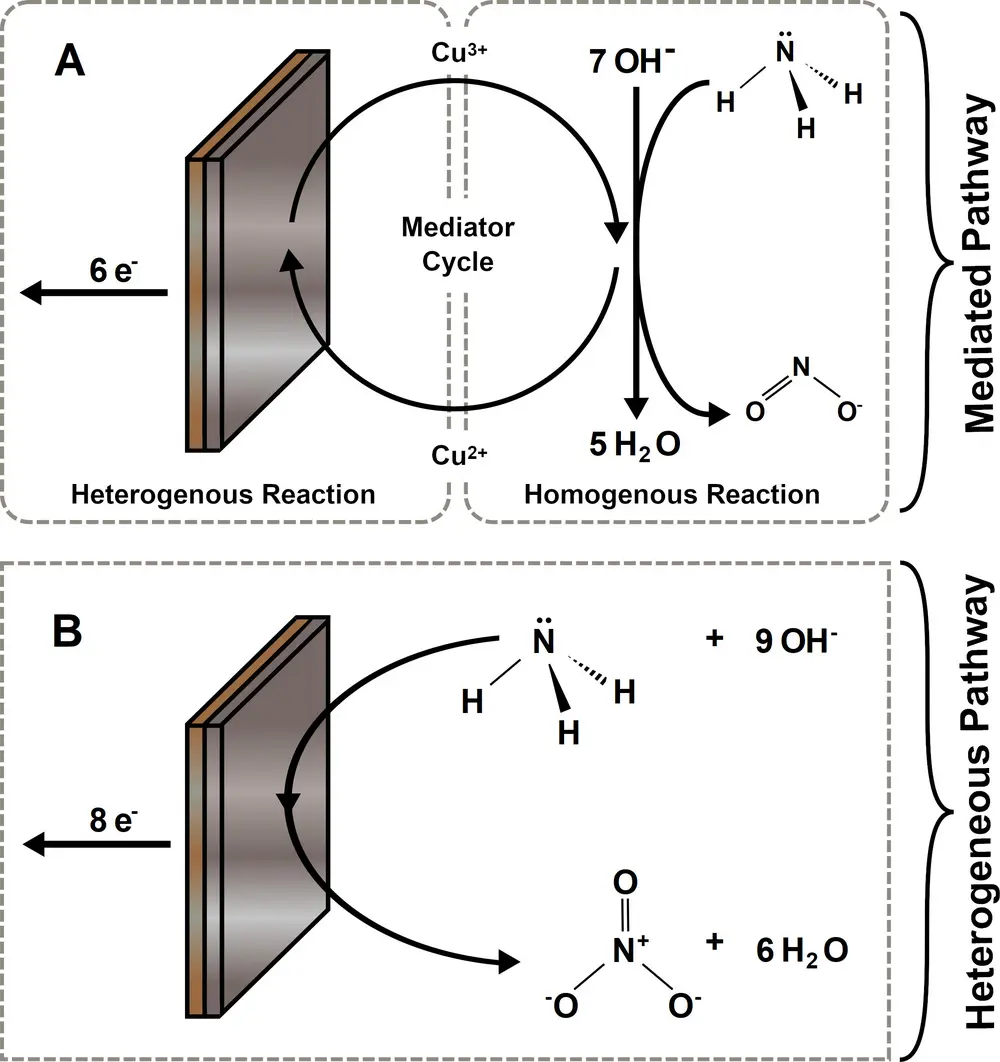
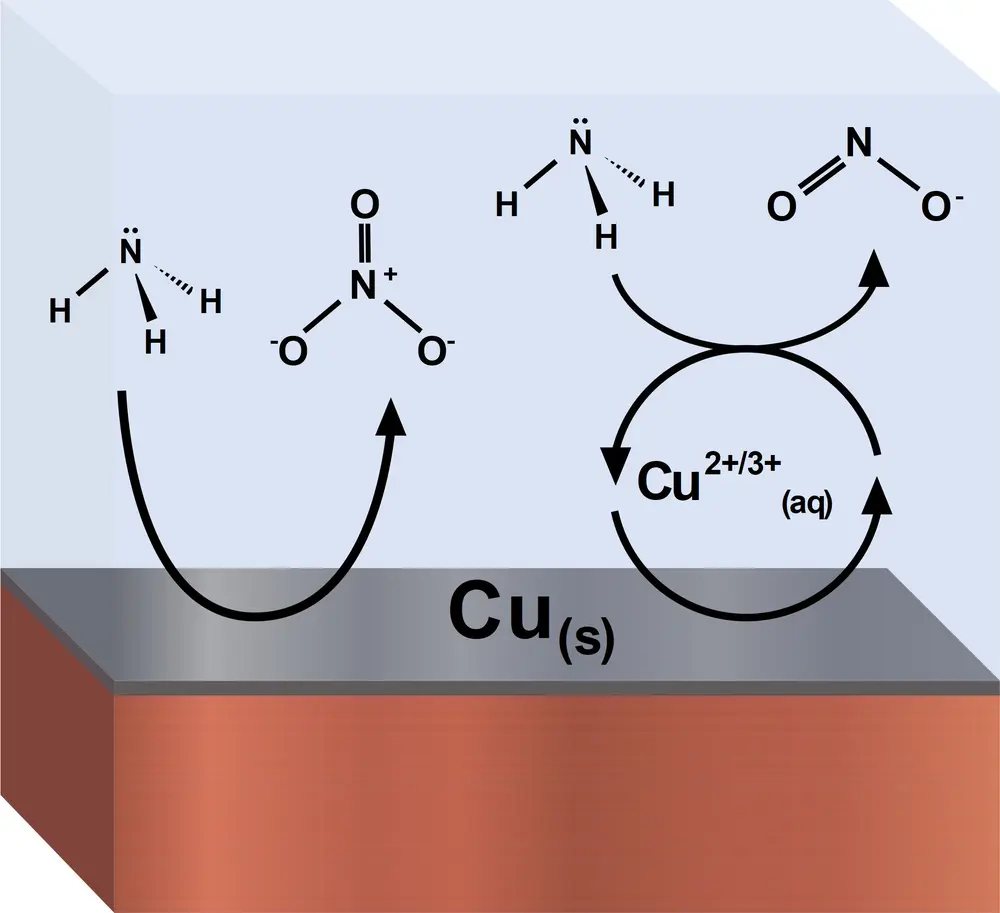
Een duurzaam alternatief voor deze technologieën is de elektrokatalytische oxidatie van ammoniak met duurzame energie bij kamertemperatuur voor een gedecentraliseerde productie van nitrieten of nitraten. Het oxideren van ammoniak gebeurt meestal met edelmetaalkatalysatoren. Maar in de natuur kan het enzym ammoniamono-oxygenase met Cu(II) in het actieve centrum ammoniak oxideren. Dit vormt de inspiratie voor het bestuderen [1] van koper als katalysator, waarbij er tevens wordt gebruikgemaakt van het feit dat een gedeelte van het koper oplost in basische oplossingen met ammoniak. Er werd ontdekt dat je afhankelijk van de pH en de potentiaal de ammoniakoxidatie kunt sturen naar nitraatproductie of juist nitrietproductie (zie Figuur 1 en Figuur 2). Dit vindt dan plaats in een elektrochemische cel met aan de anode nitrietvorming of nitraatvorming. Het elektrolyt bevat KOH en NH4OH opgelost in water, en koperplaten of draden zijn de elektroden. In het elektrolyt vindt er een homogene katalyse plaats voor de reactie naar nitrietvorming:
NH3 + Cu3+ + 7 OH- → NO2- + Cu2+ + 5 H2O + 5 e-
Deze homogene elektrokatalyse naar nitriet wordt ondersteund door redoxtransformatie van [Cu(OH)4]-/2- moleculen die oplossen vanaf de koperelektrode. De stabiele en continue wijze van deze homogene katalyse werd aangetoond met experimenten die een week duurden. Deze homogene elektrokatalyse heeft een hoge selectiviteit en wordt minder gestoord door elektrodevergiftiging door sterk geabsorbeerde "N"-intermediairen die het elektrokatalytische oxidatieveld voor ammoniak vervuilen.
Aan de koperelektrode vindt de heterogene katalyse plaats voor de reactie naar nitraatvorming:
NH3 + 9 OH- → NO3- + 6 H2O + 8 e-
Dat er twee katalytische mechanismen zijn voor de elektro-oxidatie van ammoniak op koper is ontdekt door het effect van de pH van het elektrolyt en het potentiaal te bestuderen met voltametrische analyse en in situ Ramanspectroscopie. De selectiviteit van de door koper gekatalyseerde oxidatie van ammoniak naar nitriet of nitraat wordt bereikt door het balanseren tussen de kinetiek van de twee reactiemechanismen door het instellen van de pH van het elektrolyt en het potentiaal. Er werd een Faraday-efficiëntie gevonden van 86% met een hoge elektrokatalytische activiteit en selectiviteit voor de oxidatie van ammoniak naar nitriet of nitraat in basische oplossingen. De ontdekking vormt een stevige basis voor het selectief oxideren van ammoniak naar nuttige grondstoffen.
Referentie
[1] Johnston, Sam, et al. "Copper‐catalyzed Electrosynthesis of Nitrite and Nitrate from Ammonia: Tuning the Selectivity via an Interplay between Homogeneous and Heterogeneous Catalysis." ChemSusChem 14.21 (2021): 4793–4801.

