EEN NIEUWE HERLAADBARE ZINKBATTERIJ
Veiliger dan de lithium-ionbatterij
Lithium-ionbatterijen worden breed toegepast, van mobiele telefoons tot accu-aangedreven voertuigen. Hoewel de 'Li-ion'-technologie snel verbetert, is ze nog steeds niet zonder risico. Dergelijke batterijen kunnen namelijk 'spontaan' ontbranden of zelfs ontploffen. Vaak hoor je van schuurbrandjes veroorzaakt door elektrische fietsen met slechte accu's. Ook de problemen met de Samsung Galaxy Note 8 in 2016 en de Boeing 787 'Dreamliner' in 2013 en 2017 zijn nog niet vergeten.

OORZAAK
Het probleem ontstaat van binnenuit. Met name tijdens het laden is er een gevaar op oververhitting. Hierdoor kan er een interne kettingreactie ('thermal runaway') optreden, waardoor de accu ontbrandt. Ook kan door interne kortsluiting de batterij steeds warmer worden met boven de 180 ºC een explosie. De accu genereert zijn eigen zuurstof, waardoor er al snel een felle brand optreedt.
Een probleem waarmee afvalbedrijven kampen vormen lithium-ionbatterijen van elektrische fietsen die in het reguliere afval terechtkomen. Daar kunnen ze spontaan in de brand vliegen met alle mogelijk desastreuze gevolgen vandien.
ALTERNATIEF VOOR LI-ION
Op water gebaseerde batterijen vliegen niet in brand, maar hun energieopslagcapaciteit is tot nu toe te beperkt. Voor het eerst is er nu een batterij die kan concurreren met de lithium-ionbatterijen in energiedichtheid en herlaadbaarheid - zonder het risico op explosie of brand - door een oude batterijtechnologie (metaal-zinkanode) te combineren met een nieuwe (water-in-zoutelektrolyten). Met een geconcentreerde waterige oplossing van een organolithiumverbinding als elektrolyt kunnen zinkanodes worden toegepast in accu's zonder dat ze snel achteruitgaan. En je hoeft geen water bij te vullen, zodat hermetisch afgesloten cellen mogelijk worden. Deze nieuwe batterij kan uiteindelijk niet alleen in consumentenelektronica worden gebruikt, maar ook met een grotere veiligheid onder extreme omstandigheden in de luchtvaart, voor militaire toepassingen en onder water.
Met een geconcentreerde waterige oplossing van een organolithiumverbinding als elektrolyt zijn zinkanodes toe te passen in accu's zonder dat ze snel degraderen. En je hoeft geen water bij te vullen, zodat hermetisch afgesloten cellen mogelijk worden.
PROBLEMEN MET DE OUDE ZINKBATTERIJEN
Zink is een van de elektrodematerialen die het langst worden toegepast (zie Figuur 1), maar dan met name in batterijen voor eenmalig gebruik. De oppervlaktechemie van zink in water leent zich slecht voor laadcycli waarbij een deel van het metaal in oplossing moet gaan (volgens Zn → Zn2+ + 2 e-) en vervolgens weer moet neerslaan. De Coulombische efficiëntie (CE) is erg beperkt en het oppervlak wordt tijdens het (ont)laden vervuild ten gevolge van dendrietvorming (kristalvorming). Bovendien zijn er nevenreacties met water dat dus regelmatig moet worden bijgevuld. Sterk gebonden zinkaatcomplexen bevorderen de dendrietvorming nog verder.
De oppervlaktechemie van zink in water leent zich slecht voor laadcycli waarbij een deel van het metaal in oplossing moet gaan en vervolgens weer moet neerslaan
Vandaar dat zinkaccu's vrijwel helemaal zijn verdrongen door efficiëntere lithium-ionaccu's, ook al is lithium duurder en zijn de bijbehorende (watervrije) elektrolytvloeistoffen brandbaar en toxisch. De problemen met zink worden volgens Wang [1] vooral veroorzaakt doordat Zn2+ zich te sterk aan de watermoleculen bindt. Je krijgt (Zn(H2O)6)2+, wat het neerslaan van zink op de elektrode in de weg staat. De sterke interactie tussen Zn2+ en watermoleculen vormt een hoge energiebarrière voor de gehydrateerde Zn2+ om te dehydrateren en neer te slaan op de zinkanode. De hydratatie van Zn2+ in water is zo sterk dat zinkhydroxide (ZnOH2) makkelijk kan worden gevormd. Dit komt doordat bij de gehydrateerde Zn2+-ionen ladingstransport plaatsvindt via de ZnOH2-binding met elektronen die de 3d1 bindende moleculaire orbitalen van de gehydrateerde water verlaten voor de lege Zn2+-orbitalen met als resultaat een behoorlijk verzwakte OH-binding in het watermolecuul. Hierdoor kan het water een proton verliezen met als gevolg een daling van de pH en het ontstaan van zinkhydroxide Zn(OH)2 en ook zelfs zinkoxide. Het gevormde zinkhydroxide wordt namelijk omgezet in zinkoxide (ZnO) als de limiet van de oplosbaarheid van het zinkhydroxide wordt bereikt. De vorming van vaste ZnO kan een moeilijk proces zijn om om te draaien tijdens het opladen, omdat het afhankelijk is van de oplosbaarheid van de ZnO, weer in de elektrolyt, voorafgaand aan de reductie tijdens het opladen.
WERKING VAN DE NIEUWE ZINKBATTERIJ
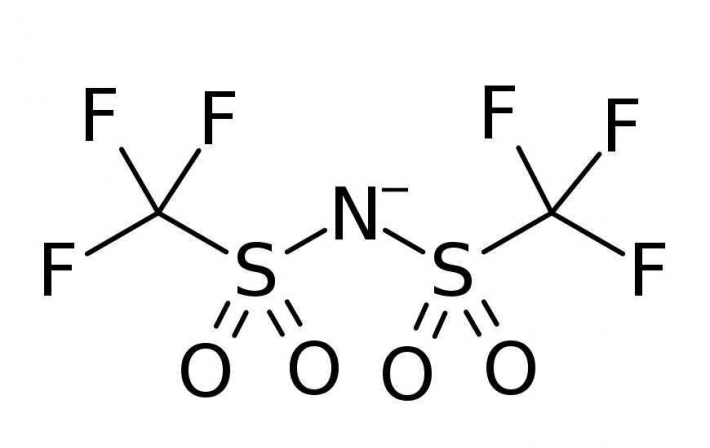
Volgens Wang [1] moet de oplossing gezocht worden in een anion dat nog sterker aan Zn2+ bindt dan water. Een stof die hieraan voldoet, is bis(trifluormethaansulfonyl)imide (TFSI-, met de formule [(CF3SO2)2N]-, zie Figuur 2).
Dit anion wordt veel gebruikt in ionische vloeistoffen. Aan het water kan maar liefst 22 mol TFSI- per kilogram toegevoegd worden, waarvan 20 mol als LiTFSI en 2 mol als Zn(TFSI)2. Volgens Wang [2] is het eerder water in zout dan omgekeerd. Drie TFSI--ionen kunnen dan één Zn2+ helemaal omringen, zodat er geen water meer in de buurt kan komen.
De hoge concentratie van TFSI--ionen dwingt in de aanwezigheid van Zn2+-ionen tot de vorming van (Zn-TFSI)+-ionparen die significant de aanwezigheid van (Zn(H2O)6)2+ onderdrukken. TFSI- bindt zelf wél water, in die mate dat er geen deksel op de accu hoeft. Een cel die blootgesteld werd aan de atmosfeer met de elektrolyt (1 m Zn(TFSI)2 + 20 m LiTFSI), kon niet alleen het water behouden gedurende veertig dagen, maar had zelfs een kleine gewichtstoename, wat erop duidt dat de elektrolyt water onttrok aan de atmosfeer. In de elektrolyt (1 m Zn(TFSI)2 + 20 m LiTFSI) is de Zn2+ solvatatieschil eerstens bezet met TFSI--ionen met zes gecoördineerde O-atomen allemaal afkomstig van TFSI--ionen. In de elektrolyt (1 m Zn(TFSI)2 + 20 m LiTFSI) is water niet meer aanwezig in het Zn2+ solvatatieschil. Met een LiMn2O4-kathode wist Wang [1] een accu te bouwen met een Coulombische efficiëntie tegen de 100%. Die leverde 180 Wh/kg en had na vierduizend laadcycli nog 80% van zijn capaciteit. Dat betekent een grote flexibiliteit en reversibiliteit voor de nieuwe zinkbatterij, die efficiënt is en onbrandbaar [3]. De conclusie is dat de elektrolyt (1 m Zn(TFSI)2 + 20 m LiTFSI) een breed scala aan unieke eigenschappen bezit die bruikbaar zijn voor verdunde zinkelektrolyten die een reversibele en dendrietvrije zinkneerslag en oplossing mogelijk maken met CE ≅100%.
De elektrolyt (1 m Zn(TFSI)2 + 20 m LiTFSI) bezit een breed scala aan unieke eigenschappen die bruikbaar zijn voor verdunde zinkelektrolyten die een reversibele en dendrietvrije zinkneerslag en oplossing mogelijk maken met CE ≅100%
Theoretisch is een bijna 100% CE nodig voor het bereiken van een lange termijn cyclische stabiliteit van zinkbatterijen, anders is een grote hoeveelheid zink nodig om de zinkconsumptie te compenseren, wat het actuele capaciteitsverbruik en de actuele energiedichtheid verlaagt. Blijkbaar is de elektrolyt (1 m Zn(TFSI)2 + 20 m LiTFSI) verantwoordelijk voor de hoge CE van zink. Daarin werd een CE > 99,7% gemeten voor meer dan 200 cycli, wat bewijst dat vrijwel al het op de anode neergeslagen zink in oplossing kon komen in het volgende 'stripping'-proces. Het team van Wang [1] meent dat deze nieuwe batterijtechnologie de basis is voor nieuw onderzoek en ze zijn hoopvol over de verdere mogelijkheden voor commercialisering.
REFERENTIES
[1] F. Wang, T. Gao, X. Fan, W. Sun, F. Han, A. Faraone, J. A. Dura, K. Xu & C. Wang
Highly reversable zinc metal anode for aqueous batteries, Nature materials 17, 543-549 (2018)
[2] Arjen Dijkgraaf, Zout houdt zinkanode goed, www.c2w.nl, 23 april 2018
[3] zinkionen getemd, C2W juni 2018, pagina 66

